Obnova svalů po fyziologickém poškození závisí na jaderné migraci pro rekonstrukci buněk
Kontraktilní funkce kosterního svalu je závislá na vícejaderných svalových buňkách (myofibryly), které se skládají ze sarkomer spojených strukturálními proteiny. Navzdory vrozené svalové síle a pružnosti může mechanické namáhání a stres způsobit poškození svalů, které se opravuje pomocí kmenových buněk (satelitní buňky). Fyzické cvičení vyvolává mírná muskuloskeletální zranění, která vyžadují rychlou a účinnou opravu, aby byla zachována svalová homeostáza.
Obecně se předpokládá, že homeostáza a regenerace kosterního svalu závisí výhradně na satelitních buňkách. Oproti tomuto pohledu zaměřenému na kmenové buňky jsme ukázali, že integrita svalu je udržována také prostřednictvím alternativního mechanismu autonomní opravy myofibry. Pomocí in vitro, ex vivo a in vivo modelů lokálního poškození svalu jsme identifikovali migraci jader jako ústřední mechanismus pro rychlé lokální uvolnění mRNA nezbytné pro produkci proteinů a opravu poškozené sarkomery.
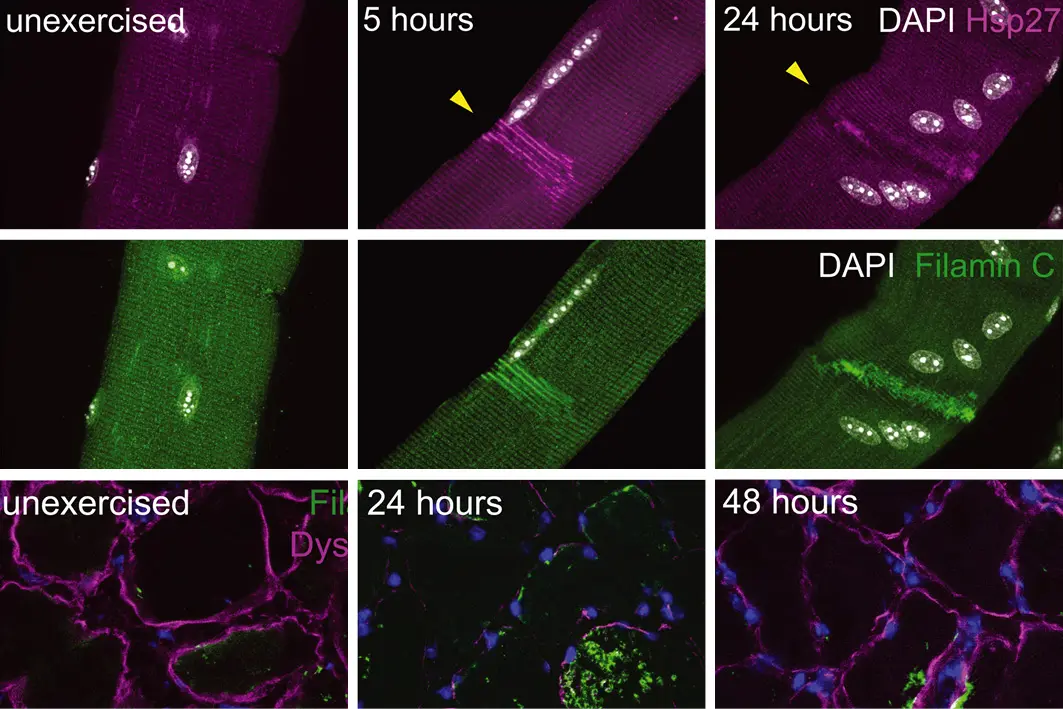
Regenerace kosterního svalu je vysoce synchronizovaný proces, který vyžaduje svalové kmenové buňky (satelitní buňky). Zjistili jsme, že lokalizovaná poranění, k nimž dochází při cvičení, aktivují samoopravu myofibry. která je u myší a lidí nezávislá na satelitních buňkách. Poranění myšího svalu spouští signalizaci, která přitahuje jádra svalových buněk do poškozeného místa prostřednictvím signální kaskády zahrnující vápník, Cdc42 a fosfokinázu C přes mikrotubuly a dynein. Tyto pohyby jader urychlují opravu sarkomery a lokálně dodávají messenger RNA (mRNA) pro buněčnou rekonstrukci. Samooprava myofibry je buněčně autonomní ochranný mechanismus a představuje alternativní model pro pochopení obnovy svalové architektury ve zdraví a nemoci.

Fig. 1 – Myonuclei migrate to local injuries
Roman W, Pinheiro H, Pimentel MR, Segalés J, Oliveira LM, García-Domínguez E, Gómez-Cabrera MC, Serrano AL, Gomes ER, Muñoz-Cánoves P. Muscle repair after physiological damage relies on nuclear migration for cellular reconstruction. Science. 2021 Oct 15;374(6565):355-359. doi: 10.1126/science.abe5620. Epub 2021 Oct 14. PMID: 34648328.